作为人体重要的内源性活性物质,组胺具有十分广泛而重要的生理作用,参与了多种生理病理反应。组胺主要通过组胺受体发挥其生理功能,后者在医药学领域一直被视为是很有前途的治疗靶点。记者4月12日从哈尔滨工业大学获悉,该校生命科学中心何元政教授课题组4月7日在最新一期《自然-通讯》杂志上在线发表了一篇学术论文,该团队首次利用冷冻电镜对人组胺受体复合物(1/Gq)的结构进行了解析,锁定了配体组胺在人组胺受体1蛋白活性口袋中的位置。这项研究成果为今后过敏性疾病新药设计开发提供了重要依据。经检索查新结果证实,以上科研成果为国内外首次报道。

过敏性疾病可见于临床各个学科,常见的有过敏性鼻炎和哮喘、荨麻疹、湿疹、药物过敏和食物过敏等。日常生活中,过敏物质无处不在,有过敏体质的男女老少皆可遭遇过敏性疾病,其发病率之高、涉及面之广,已逐渐为越来越多的人感同身受。何元政教授介绍,G蛋白是一种异源三聚体蛋白,不同的受体经过配体诱导后募集相应的G蛋白,并触发下游一系列信号级联反应。而组胺受体是一类G蛋白偶联受体,包括受体1-4等四种亚型,其中受体1能被其内源性配体组胺激活,并可在整个身体的平滑肌、血管内皮细胞、心脏和中枢神经系统中进行特异性表达,在过敏性疾病中扮演了重要“角色”。
临床上,抗组胺药物的开发距今已有半个多世纪的历史,并一直用作过敏性疾病的首选治疗方法。不足的是,第一代抗组胺药血脑屏障通透性高,受体选择性低,容易引起嗜睡、口干等问题。第二、三代抗组胺药,如西替利嗪、氯雷替丁、非索非那定等,尽管能显著降低脑通透性,但与受体亲和力低,且有心脏毒性。目前,最成功的抗组胺药物多是带有一个碱性氨基的大分子,这与组胺的咪唑环和乙胺侧链有很大不同,而这些大分子的抗组胺药阻断组胺受体1信号的机制迄今仍是待解之“谜”。
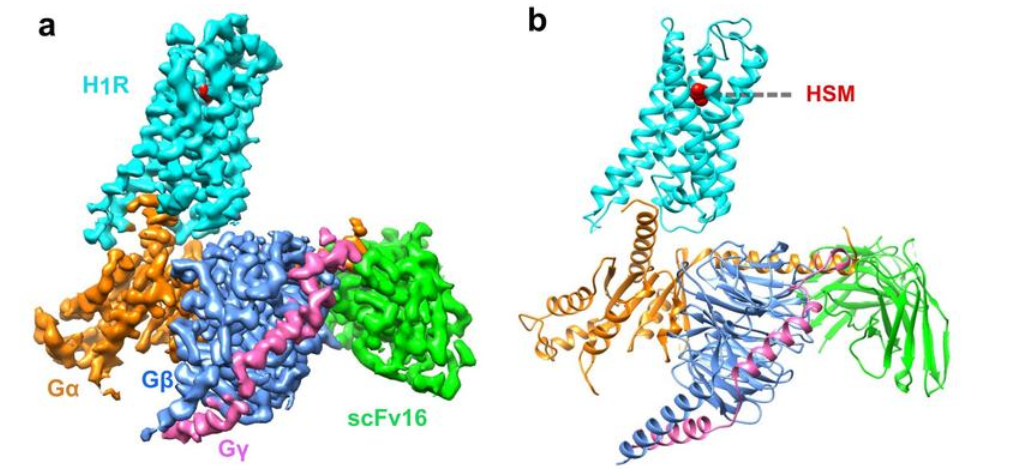
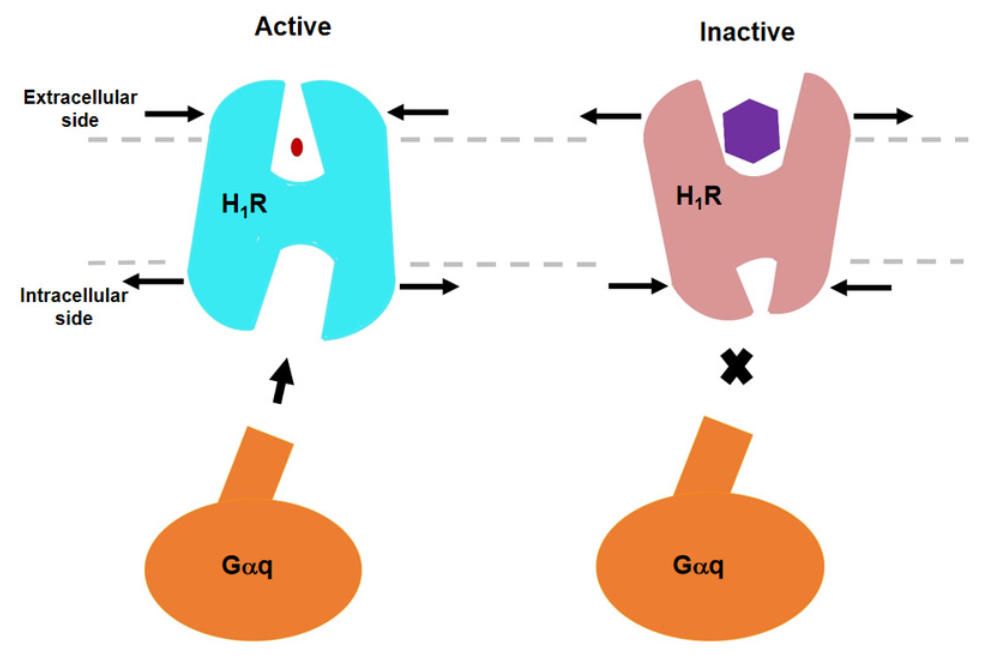
在国家自然基金等项目支持下,何元政教授及团队凭借冷冻电镜,清晰地“勾勒”出了人组胺受体1与Gq蛋白的复合物结构。这一结构显示,组胺通过与跨膜结构域3和跨膜结构域6的关键残基相互作用激活受体,挤压细胞外侧的结合口袋,打开细胞内侧的空腔,使Gq蛋白募集。相反,抗组胺药借助其庞大的基团将跨膜结构域3和跨膜结构域6推开,扩展了配体结合口袋,形成了一种“挤压激活,扩张失活”的模型。结构的详细分析为理解G蛋白分子偶联的选择性搭建了一个完美框架,并为设计更加有效、副反应更轻微的新型抗组胺药物提供了重要线索。
据了解,过去10年间,在分析大分子结构时,冷冻电镜一直都是科学家“工具箱”中最得力的“利器”。而在上述重大成果中,何元政教授课题组在国内外首次利用这一冷冻电镜技术,精准“描绘”了人组胺受体复合物(1/Gq)的结构,使研究者清楚地观察到小分子是如何结合在蛋白质的活性口袋中,由此拓展了冷冻电镜的应用范围和研究深度。








 公安备案号:32010202010067
公安备案号:32010202010067